Olá pessoal!
Na aula de hoje é para vocês copiarem o texto abaixo com as informações necessárias, e vamos revisar um pouco. Não esqueçam de organizar o caderno e colocar a data correta, pois será usado na próxima aula.
Forças intermoleculares:
Forças intermoleculares: Forças intermoleculares são as forças exercidas para manter unidas duas ou mais moléculas.
Elas correspondem a ligações químicas que têm a função de unir ou repelir as moléculas de um composto.
As forças intermoleculares provocam estados físicos diferentes nos compostos químicos. Essa interação pode ser mais ou menos forte, conforme a polaridade das moléculas.
Classificação:
As forças intermoleculares são classificadas em três tipos que variam conforme a intensidade:
- Ligação de Hidrogênio: Ligação de forte intensidade.
- Dipolo Permanente ou dipolo-dipolo: Ligação de média intensidade.
- Dipolo Induzido ou Forças de London: Ligação de fraca intensidade.
O conjunto das forças intermoleculares também pode ser chamado de Forças de Van der Waals.;
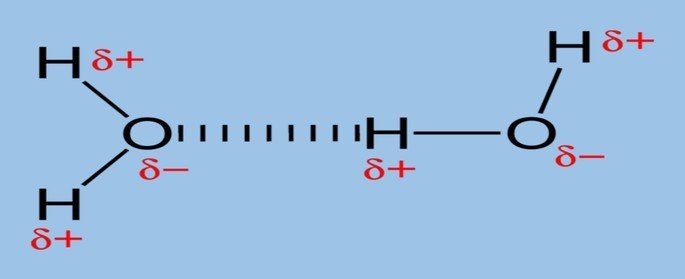
LigA ligação ou ponte de hidrogênio ocorre em moléculas polares que têm o hidrogênio unido à elementos eletronegativos e com volume atômico baixo, como o oxigênio (O), flúor (F) e nitrogênio (N).
É a força intermolecular mais forte, pois existe uma grande diferença de eletronegatividade entre os elementos.
Um exemplo de ligação de hidrogênio ocorre na molécula de água (H2O) nos estados sólido e líquido.