Colégio Estadual Hermógenes Coelho
Professor Fabio Venâncio de Oliveira
Disciplina: Química Serie: 2 A e B
Aulas
não presenciais – Química Analítica.
Olá,
queridos alunos!
Espero
que tenham gostado de estudar as concentração em número de mols. (Continuação
da aula anterior.)
Para hoje, teremos duas atividades e para que
tenhamos sucesso é muito importante o seu compromisso e sua dedicação.
1ª ATIVIDADE:
.
A concentração em quantidade de matéria é a relação entre a quantidade de matéria do soluto, medida em mol (n1), e o volume da solução em litros (V). Essa concentração é medida em mol por litro (mol/L).
A concentração em quantidade de matéria é a relação entre a quantidade de matéria do soluto, medida em mol (n1), e o volume da solução em litros (V). Essa concentração é medida em mol por litro (mol/L).
Consideremos o suco gástrico que nosso estômago produz com a
finalidade de realizar o processo de digestão. Na realidade, trata-se de uma
solução de ácido clorídrico (HCl) em uma concentração de 0,01 mol/L. Isso
significa que, para cada litro de suco gástrico, há 0,01 mol de HCl.
A concentração em quantidade de matéria é
muitas vezes chamada por alguns autores de concentração molar ou molaridade,
mas os termos corretos são “concentração em mol/L” ou“concentração em
quantidade de matéria”. Além disso, essa concentração é a mais recomendada pelo
Sistema Internacional de Unidades (SI) e pela União Internacional da Química
Pura e Aplicada (IUPAC); portanto, ela é a mais usada em laboratórios e
indústrias químicas.
Mapa
Mental: Unidade de Concentração em Mol/L
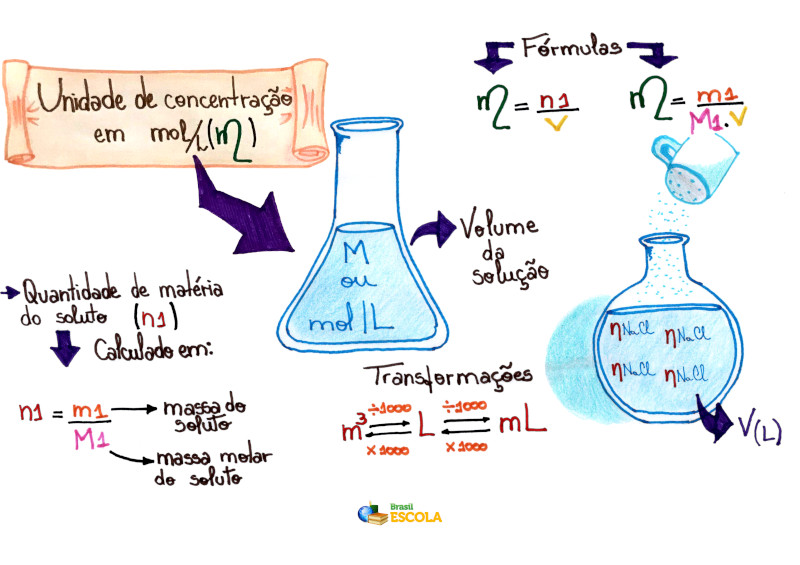
* Para baixar
o mapa mental em PDF, clique aqui!
Fórmulas
utilizadas na molaridade
A fórmula matemática usada para calcular essa concentração é dada
por:

Em muitos
casos, não é fornecido o valor da quantidade de matéria do soluto, mas, sim, a
sua massa expressa em gramas (m1). Nesses casos, temos que a quantidade
de matéria do soluto em mols (n1) pode ser conseguida pela divisão da
massa do soluto pela massa molar do próprio soluto, conforme a fórmula a
seguir:
Exemplo de
cálculo de molaridade
Considere o seguinte exemplo para visualizar como é feito esse
cálculo:
“Uma solução aquosa com 100 mL de volume
contém 20 g de NaCl. Como proceder para expressar a concentração dessa solução
em quantidade de matéria por volume?”
Resolução:
Bom, a fórmula a ser utilizada é a mesma mostrada acima, mas o
volume não está em litros. Assim, devemos fazer a seguinte conversão de
unidades:
1 L ------
1000 mL
V ------ 100 mL
V = 0,1 L
V ------ 100 mL
V = 0,1 L
Também é
necessário descobrir o valor da massa molar do sal NaCl. Para tal, é preciso
saber os valores das massas atômicas de ambos os elementos e realizar o cálculo
da massa molar , que é ensinado no texto “Massa Molar e Número de Mol”:
M (NaCl) = 1. 23 + 1 . 35, 46
M (NaCl) = 58,46 g/mol
Agora podemos substituir todos os valores na fórmula e descobrir o
valor da concentração em mol/L:
m =
n1
M1.V
M1.V
M =
20
58, 46.0,1
58, 46.0,1
M = 3,4 mo/L
OBS: QUANDO
RETORNARMOS AS AULAS PRESENCIAIS, IREI CONFERIR A SUA CORREÇÃO.
Ao terminar a
correção, coloque a data de hoje e escreva a atividade que foi desenvolvida.
ASSIM:
Data: 02/04/20
- Correção da s atividade sobre Misturas e classificação"
Então
vamos lá!
NO
CADERNO DE QUIMICA GERAL ESCREVA:
TÍTULO DA
ATIVIDADE: “ concentração em número de mols”
DATA: 02/04/2020
RECURSO: Livro didático de química s no capítulo
03 do seu livro.
PROPOSTA
Fazer a leitura das atividades propostas
e resolve-las de acordo com conteúdo anexo, para que tenham maior conhecimento do conteúdo
proposto.
Questão
1
Uma solução de 368 g de glicerina (C3H8O3) em 1600 g de água
apresenta densidade de 1,044 g/cm3. Calcule a
concentração em mol/L dessa solução. Dados: massas atômicas: H = 1; C = 12; O
=16.
Questão
2
Qual massa de ácido sulfúrico (H2SO4) será necessária
para preparar 2 litros de uma solução na concentração de 3 mol/L? Dado: M(H2SO4) = 98 g/mol.
Professor
Fabio Venâncio de Oliveira.
A inovação distingue um líder de um
seguidor.
Steve
Jobs